ANSM - Mis à jour le : 14/02/2023
SMOFKABIVEN, émulsion pour perfusion Veuillez lire attentivement cette notice avant d'utiliser ce médicament car elle contient des informations importantes pour vous.· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d'autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d'autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que SMOFKABIVEN, émulsion pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser SMOFKABIVEN, émulsion pour perfusion ?
3. Comment utiliser SMOFKABIVEN, émulsion pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SMOFKABIVEN, émulsion pour perfusion ?
6. Contenu de l'emballage et autres informations.
1. QU'EST-CE QUE SMOFKABIVEN, émulsion pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
SMOFKABIVEN est une émulsion destinée à être perfusée goutte-à-goutte dans une veine (perfusion intraveineuse). Ce produit contient des acides aminés (composés utilisés par l'organisme afin de construire les protéines), du glucose (glucides) et des lipides (graisses) dans une poche en plastique et peut être donné à des adultes et des enfants à partir de 2 ans.
Un professionnel de santé vous administrera SMOFKABIVEN si d'autres formes d'alimentation n'ont pas été suffisantes ou n'ont pas agi.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER SMOFKABIVEN, émulsion pour perfusion ?
N'utilisez jamais SMOFKABIVEN, émulsion pour perfusion :Adressez-vous à votre médecin, à votre pharmacien ou à votre infirmier/ère avant d'utiliser SMOFKABIVEN, émulsion pour perfusion si vous avez l'un des problèmes suivants :
Prévenez immédiatement le professionnel de santé si vous ressentez l'un des troubles suivants pendant la perfusion : fièvre, éruption, gonflement, difficulté à respirer, frissons, sueurs, nausées ou vomissements, car il peut s'agir de manifestations d'une réaction allergique ou de signes indiquant que vous avez reçu une trop grande quantité de SMOFKABIVEN.
Votre médecin contrôlera régulièrement votre formule sanguine afin de vérifier votre fonction hépatique et les autres éléments du sang.
Enfants et adolescentsSMOFKABIVEN ne doit pas être utilisé chez le nouveau-né ni chez l'enfant de moins de deux ans. SMOFKABIVEN peut être donné aux enfants entre 2 et 18 ans.
Autres médicaments et SMOFKABIVEN, émulsion pour perfusionInformez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
SMOFKABIVEN E, émulsion pour perfusion avec des aliments, boissons et de l'alcoolSans objet.
Grossesse et allaitementSi vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Il n'existe aucune donnée sur l'administration de SMOFKABIVEN au cours de la grossesse ou de l'allaitement. SMOFKABIVEN ne doit donc être administré à une femme enceinte ou qui allaite que si le médecin le juge nécessaire. L'utilisation de SMOFKABIVEN pendant la grossesse ou l'allaitement ne doit être envisagé que sur les conseils de votre médecin.
Conduite de véhicules et utilisation de machinesSans objet.
SMOFKABIVEN, émulsion pour perfusion contient <{nommer le/les excipient (s)}>Sans objet.
3. COMMENT UTILISER SMOFKABIVEN, émulsion pour perfusion ?
Posologie
Votre médecin décidera de la dose vous convenant en fonction de votre poids et de l'état de vos fonctions.
Mode d'administration
SmofKabiven vous sera administré par un professionnel de santé.
Si vous avez utilisé plus de SMOFKABIVEN, émulsion pour perfusion que vous n'auriez dûConsultez immédiatement votre médecin ou votre pharmacien.
Il est peu probable que vous receviez une quantité trop élevée de SMOFKABIVEN, car il vous sera administré par un professionnel de santé.
Si vous oubliez d'utiliser SMOFKABIVEN, émulsion pour perfusion Si vous arrêtez d'utiliser SMOFKABIVEN, émulsion pour perfusionSans objet.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin, à votre pharmacien ou à votre infirmier/ère
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Fréquent (plus d'un patient sur 100) : légère augmentation de la température corporelle.
Peu fréquent (moins d'un patient sur 100 mais plus d'un patient sur 1 000) : concentration sanguine (plasma) élevée de composés provenant du foie, manque d'appétit, nausées, vomissements, frissons, étourdissements et maux de tête.
Rare (moins d'un patient sur 1 000 mais plus d'un patient sur 10 000) : pression artérielle basse ou élevée, difficulté à respirer, battements rapides du cur (tachycardie). Réactions d'hypersensibilité (pouvant se traduire par des symptômes tels que gonflement, fièvre, diminution de la pression artérielle, éruption cutanée, urticaire (plaques rouges en relief), bouffées de chaleur, maux de tête). Sensations de chaleur et de froid. Pâleur. Légère coloration bleue des lèvres et de la peau en raison d'un taux trop bas d'oxygène dans le sang. Douleurs au niveau du cou, du dos, des os, de la poitrine et des lombaires.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, à votre pharmacien ou à votre infirmier/ère. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d'informations sur la sécurité du médicament.
5. COMMENT CONSERVER SMOFKABIVEN, émulsion pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N'utilisez pas ce médicament après la date de péremption indiquée sur la poche et sur l'étiquette de la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C. Ne pas congeler. Conserver dans le suremballage.
N'utilisez pas ce médicament si vous remarquez des signes visibles de détérioration
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d'éliminer les médicaments que vous n'utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L'EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient SMOFKABIVEN, émulsion pour perfusion
·Les substances actives sont (pour 1000 ml) :
Alanine.............................................................................................................................. 7,1 g
Arginine............................................................................................................................. 6,1 g
Glycine.............................................................................................................................. 5,6 g
Histidine............................................................................................................................ 1,5 g
Isoleucine.......................................................................................................................... 2,5 g
Leucine.............................................................................................................................. 3,8 g
Lysine (sous forme d'acétate)............................................................................................. 3,4 g
Méthionine......................................................................................................................... 2,2 g
Phenylalanine..................................................................................................................... 2,6 g
Proline............................................................................................................................... 5,7 g
Sérine................................................................................................................................ 3,3 g
Taurine.............................................................................................................................. 0,5 g
Thréonine........................................................................................................................... 2,2 g
Tryptophane...................................................................................................................... 1,0 g
Tyrosine........................................................................................................................... 0,20 g
Valine................................................................................................................................ 3,1 g
Glucose (sous forme monohydratée).................................................................................. 127 g
Huile de soja, raffinée....................................................................................................... 11,4 g
Triglycérides à chaîne moyenne......................................................................................... 11,4 g
Huile d'olive, raffinée.......................................................................................................... 9,5 g
Huile de poisson, riche en acides gras oméga-3.................................................................. 5,7 g
Glycérol, phospholipides d'oeuf purifiés, tout-rac-a-tocophérol, hydroxyde de sodium (ajustement du pH), oléate de sodium, acide acétique (ajustement du pH), acide chlorhydrique (ajustement du pH) et eau pour préparations injectables.
Qu'est-ce que SMOFKABIVEN, émulsion pour perfusion et contenu de l'emballage extérieur
Ce médicament se présente sous forme d'une émulsion pour perfusion. Les solutions de glucose et d'acides d'aminés sont limpides, incolores ou légèrement jaunes et dépourvues de particules. L'émulsion lipidique est blanche et homogène.
Poches de : 493 ml (boîtes de 1 et 6) ;986 ml (boîtes de 1 et 4) ; 1477 ml (boîtes de 1 et 4) ; 1970 ml (boîtes de 1 et 4) ; 2463 ml (boîtes de 1 et 3).
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l'autorisation de mise sur le marché
FRESENIUS KABI France5, PLACE DU MARIVEL
92316 SEVRES CEDEX
Exploitant de l'autorisation de mise sur le marché
FRESENIUS KABI France5, PLACE DU MARIVEL
92316 SEVRES CEDEX
RAPSGATAN 7
751 74 UPPSALA
SUEDE
ou
FRESENIUS KABI AUSTRIA GmbH
HAFNERSTRASSE 36
8055 GRAZ
AUTRICHE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l'ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
Mises en garde et précautions d'emploi
Afin d'éviter les risques liés à une perfusion trop rapide, il est recommandé de réaliser une perfusion continue et bien contrôlée, si possible au moyen d'une pompe volumétrique.
En raison de l'accroissement du risque d'infection associé à l'utilisation d'une veine centrale, des précautions strictes d'asepsie doivent être prises afin d'éviter toute contamination, particulièrement pendant l'insertion et la manipulation du cathéter.
Les taux sériques de glucose, d'électrolytes et l'osmolarité, de même que l'équilibre hydrique, l'équilibre acido-basique, les paramètres de la fonction hépatique et des enzymes doivent être surveillés.
Tout signe ou symptôme de réaction anaphylactique (notamment fièvre, frissons, éruption ou dyspnée) doit entraîner l'arrêt immédiat de la perfusion.
SmofKabiven ne doit pas être administré en même temps que du sang dans le même dispositif de perfusion en raison d'un risque de pseudoagglutination.
Mode d'administration
En perfusion intraveineuse par voie centrale.
Afin d'apporter une nutrition parentérale complète, des oligo-éléments, des électrolytes et des vitamines doivent être ajoutés à SmofKabiven en fonction des besoins du patient.
Posologie
Adultes
Posologie
La posologie est de 13 à 31 ml de SMOFKABIVEN/kg/jour (apportant 0,6 à 1,6 g d'acides aminés/kg/jour ce qui correspond à 0,10 à 0,25 g d'azote/kg/jour) et 14 à 35 kcal/kg/jour d'énergie totale (12 à 27 kcal/kg/jour d'énergie non protéique).
Débit de perfusion
Le débit maximal de perfusion est de 0,25 g/kg/h pour le glucose, 0,1 g/kg/h pour les acides aminés et 0,15 g/kg/h pour les lipides.
Le débit de perfusion ne doit pas excéder 2,0 ml/kg/heure (correspondant à 0,10 g d'acides aminés, 0,25 g de glucose et 0,08 g de lipides/kg/h). La durée recommandée de perfusion est de 14 à 24 heures.
Posologie maximale journalière
La posologie maximale journalière varie en fonction de l'état clinique du patient et peut même changer d'un jour à l'autre. La posologie maximale journalière recommandée est de 35 ml/kg/jour.
Population pédiatrique
Enfants (de 2 à 11 ans)
Posologie
La dose maximale de 35 ml/kg/jour doit être régulièrement ajustée en fonction des besoins de l'enfant qui varient davantage que ceux des adultes.
Débit de perfusion
Le débit de perfusion maximal recommandé est de 2,4 ml/kg/h (correspondant à 0,12 g d'acides aminés/kg/h, 0,30 g de glucose/kg/h et 0,09 g de lipides/kg/h). A ce débit maximal de perfusion, l'administration ne doit pas durer plus de 14 heures 30 minutes, sauf dans des cas exceptionnels avec une surveillance particulière.
La durée recommandée de perfusion est de 12 à 24 heures.
Posologie maximale journalière
La posologie maximale journalière varie en fonction de l'état clinique du patient et peut même changer d'un jour à l'autre. La posologie maximale journalière recommandée est de 35 ml/kg/jour.
Adolescents (de 12 à 18 ans)
Pour les adolescents, SMOFKABIVEN peut être utilisé comme chez les adultes.
Précautions particulières d'utilisation
Ne pas utiliser si le conditionnement est endommagé.
N'utiliser que si les solutions d'acides aminés et de glucose sont limpides et incolores ou légèrement jaunes et si l'émulsion lipidique est blanche et homogène. Les contenus des trois compartiments doivent être mélangés avant l'administration, et avant tout ajout par le site de supplémentation.
Après séparation des soudures pelables, la poche doit être retournée plusieurs fois afin d'assurer un mélange homogène dépourvu de tout aspect de séparation de phase.
A usage unique exclusivement. Toute solution inutilisée restant après perfusion doit être jetée.
Compatibilité
Des données de compatibilité sont disponibles avec les produits nommés Dipeptiven, Suppliven, Glycophos, Addiphos, Vitalipide Adultes/Enfants et Soluvit en quantités définies et avec des' électrolytes en concentrations définies. Lors des ajouts d'électrolytes, les quantités déjà présentes dans la poche doivent être prises en compte pour répondre aux besoins cliniques du patient. Les données obtenues justifient les ajouts dans la poche indiqués dans le tableau récapitulatif ci-dessous :
Intervalle de compatibilité stable pendant 8 jours, c'est-à-dire 6 jours de stockage à 2-8°C suivis de 48 heures à 20-25°C
|
Unités |
Quantité maximale totale |
|||||
|
Taille de la poche SmofKabiven |
ml |
493 |
986 |
1477 |
1970 |
2463 |
|
Additif |
Volume |
|||||
|
Dipeptiven |
ml |
0-100 |
0 - 300 |
0 - 300 |
0 - 300 |
0 - 300 |
|
Suppliven |
ml |
0 - 10 |
0 - 10 |
0 - 10 |
0 - 10 |
0 - 10 |
|
Soluvit |
flacon |
0 - 1 |
0 - 1 |
0 - 1 |
0 - 1 |
0 - 1 |
|
Vitalipid Adultes/Enfants |
ml |
0 - 10 |
0 - 10 |
0 - 10 |
0 - 10 |
0 - 10 |
|
Electrolytes1 |
Quantité par poche |
|||||
|
Sodium |
mmol |
≤ 75 |
≤ 150 |
≤ 225 |
≤ 300 |
≤ 375 |
|
Potassium |
mmol |
≤ 75 |
≤ 150 |
≤ 225 |
≤ 300 |
≤ 375 |
|
Calcium |
mmol |
≤ 2,5 |
≤ 5 |
≤ 7,5 |
≤ 10 |
≤ 12,5 |
|
Magnésium |
mmol |
≤ 2,5 |
≤ 5 |
≤ 7,5 |
≤ 10 |
≤ 12,5 |
|
Phosphate inorganique (Addiphos) OU Phosphate organique (Glycophos)2 |
mmol |
≤ 7,5 |
≤ 15 |
≤ 22,5 |
≤ 30 |
≤ 37,5 |
|
Zinc |
mmol |
≤ 0,1 |
≤ 0,2 |
≤ 0,25 |
≤ 0,3 |
≤ 0,35 |
|
Sélénium |
µmol |
≤ 1 |
≤ 1 |
≤ 1 |
≤ 1 |
≤ 1,15 |
1 inclut les quantités de tous les produits.
2 les ajouts de Glycophos peuvent être doublés avec une stabilité de 7 jours, c'est-à-dire 6 jours à 2-8°C suivis de 24 heures à 20-25°C
Remarque : ce tableau est destiné à indiquer la compatibilité. Il ne s'agit pas de recommandations posologiques.
Pour les médicaments cités, avant de prescrire, se référer aux informations de prescription approuvées au niveau national.
La compatibilité avec d'autres additifs et la durée de conservation de divers mélanges seront communiquées sur demande.Les ajouts doivent être effectués de façon aseptique.
Durée de conservation après mélange
La stabilité chimique et physique dans la poche à trois compartiments après mélange a été démontrée pendant 48 heures à 20-25°C. Pour des raisons de sécurité microbiologique, le produit doit être utilisé immédiatement. En cas d'utilisation non immédiate, la durée et les conditions de conservation avant administration relèvent de la responsabilité de l'utilisateur et ne doivent normalement pas excéder 24 heures à 2-8°C, sauf si les mélanges ont été effectués e conditions d'asepsie dûment contrôlées et validées.
Durée de conservation après mélange avec des additifs
La stabilité physicochimique dans la poche à trois compartiments après mélange avec des additifs (voir section 6.6) a été démontrée pendant 8 jours, c'est-à-dire 6 jours à 2°-8°C suivis de 48 heures à 20-25°C, incluant la durée d'administration. Pour des raisons de sécurité microbiologique, le produit doit être utilisé immédiatement quand un ajout a été effectué. En cas d'utilisation non immédiate, la durée et les conditions de conservation avant administration relèvent de la responsabilité de l'utilisateur et ne doivent normalement pas excéder 24 heures à 2-8°C, sauf si les mélanges ont été effectués e conditions d'asepsie dûment contrôlées et validées.
Instructions d'utilisation de SmofKabivenLa poche BIOFINE|
Poche de 986 ml, 1477 ml, 1970 ml, 2463 ml
|
Poche de 493 ml
|
1) Encoches pour ouverture du suremballage
2) Poignée
3) Orifice de suspension de la poche
4) Soudures pelables
5) Site condamné (utilisé uniquement lors de la fabrication)
6) Site de supplémentation
7) Site de perfusion
8) Absorbeur d'oxygène
1. Retrait du suremballage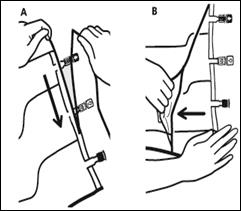 |
Pour retirer le suremballage, tenir la poche horizontalement et déchirer les encoches proches des sites de supplémentation et de perfusion (A). Retirer le suremballage et le jeter avec l'absorbeur d'oxygène (B). |
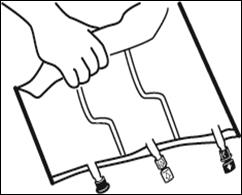 |
Placer la poche sur une surface plane. |
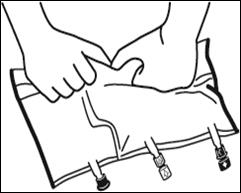 |
Faire rouler la poche doucement sur elle-même à partir de la poignée en direction des sites, en commençant avec la main droite et en exerçant une pression constante avec la main gauche jusqu'à rupture des soudures verticales. Les soudures verticales s'ouvrent sous la pression des fluides. |
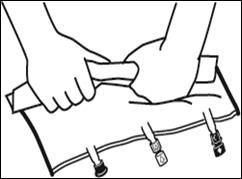 |
Le mélange peut également être effectué avant le retrait du suremballage. Remarque : les solutions se mélangent facilement, bien que la soudure horizontale reste fermée |
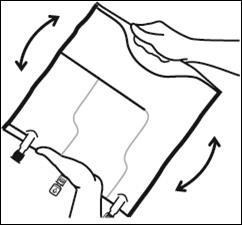 |
Mélanger le contenu des 3 compartiments en retournant la poche plusieurs fois de bas en haut jusqu'à ce que les solutions soient complètement mélangées. |
|
|
Placer la poche sur une surface plane. Juste avant d'injecter les additifs, rompre le Twist Off (flèche vers la poche) du site blanc de supplémentation (A). Remarque : la membrane à l'intérieur du site de supplémentation est stérile.
|
|
|
|
Remarque : La partie intérieure du site de perfusion est stérile.
4. Suspension de la poche|
|
Suspendre la poche par l'orifice situé sous la poignée. |
