ANSM - Mis à jour le : 13/10/2022
FOSPHENYTOINE ARROW 75 mg/mL, solution à diluer pour solution injectable/pour perfusionFosphénytoïne sodique Veuillez lire attentivement cette notice avant d'utiliser ce médicament car elle contient des informations importantes pour vous.· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d'autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
·Vous avez peut-être reçu ce médicament en une dose unique afin de contrôler un état de mal épileptique (un type de crise convulsive très sévère). Dans ce cas, vous ne serez en mesure de lire cette notice qu'après avoir reçu le médicament. Votre médecin aura tenu compte des informations de sécurité importantes que contient cette notice, mais votre besoin urgent de traitement peut avoir été plus important que certaines des précautions normales. Vérifiez-les maintenant, surtout si vous allez continuer à recevoir ce médicament (ou toute autre forme de phénytoïne).
2. Quelles sont les informations à connaître avant d'utiliser FOSPHENYTOINE ARROW 75 mg/mL, solution à diluer pour solution injectable/pour perfusion ?
3. Comment utiliser FOSPHENYTOINE ARROW 75 mg/mL, solution à diluer pour solution injectable/pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FOSPHENYTOINE ARROW 75 mg/mL, solution à diluer pour solution injectable/pour perfusion ?
6. Contenu de l'emballage et autres informations.
Classe pharmacothérapeutique : Antiépileptiques - code ATC : N03AB05.
FOSPHENYTOINE ARROW contient le principe actif fosphénytoïne qui appartient à un groupe de médicaments appelés médicaments antiépileptiques ; ces médicaments sont utilisés pour traiter l'épilepsie.
FOSPHENYTOINE ARROW est utilisé chez les adultes et les enfants âgés de 5 ans et plus :·pour contrôler les crises d'épilepsie sévères appelées état de mal épileptique, de type tonico-clonique (grand mal) ;
·pour contrôler ou prévenir les crises convulsives survenant pendant ou après une opération neurochirurgicale et/ou un traumatisme crânien ;
·pour contrôler ou prévenir les crises convulsives pendant de courtes périodes lorsque les médicaments antiépileptiques ne peuvent pas être pris par voie orale.
Vous devez vous adresser à votre médecin si vous ne savez pas pourquoi vous avez reçu ce médicament.
N'utilisez jamais FOSPHENYTOINE ARROW 75 mg/mL, solution à diluer pour solution injectable/pour perfusion :·si vous êtes allergique à la fosphénytoïne sodique, à la phénytoïne ou à d'autres antiépileptiques similaires ou à l'un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
·si vous avez des troubles du rythme cardiaque ;
·si vous avez une porphyrie aiguë intermittente (maladie héréditaire affectant la formation des globules rouges) ;
·si vous prenez de la delavirdine, un médicament antiviral utilisé pour traiter l'infection par le virus de l'immunodéficience humaine (VIH).
Veuillez informer votre médecin si vous avez l'une de ces affections. Si vous avez des questions, adressez-vous à votre médecin, pharmacien ou infirmier/ère.
Avertissements et précautionsAdressez-vous à votre médecin, pharmacien ou infirmier/ère avant d'utiliser FOSPHENYTOINE ARROW 75 mg/mL, solution à diluer pour solution injectable/pour perfusion ; en particulier si vous présentez ou avez présenté l'une des affections suivantes :
·maladie cardiaque ou accident vasculaire cérébral,
·tension artérielle basse ou insuffisance cardiaque,
·maladie du foie,
·maladie rénale,
·faible teneur en protéines (albumine) dans votre sang,
·régime alimentaire spécial limitant votre consommation de phosphate,
·diabète.
Pression artérielle diminuée et problèmes cardiaques graves
Une diminution de la pression artérielle et des problèmes cardiaques graves peuvent survenir lors de l'utilisation de FOSPHENYTOINE ARROW. Ces effets indésirables peuvent être plus graves chez les patients âgés, les enfants ou les patients gravement malades. Votre médecin surveillera donc votre cur, votre pression artérielle et votre fonction respiratoire lors de l'administration de ce médicament.
Idées autodestructrices ou suicidaires
Un petit nombre de personnes traitées avec des antiépileptiques tels que la fosphénytoïne ont eu des idées autodestructrices ou suicidaires. Si de telles pensées venaient à apparaître, à tout moment, contactez immédiatement votre médecin.
Réactions cutanées graves
Dans la population générale, des effets indésirables cutanés graves peuvent rarement se produire pendant le traitement avec FOSPHENYTOINE ARROW ; pour connaître les signes et symptômes de réactions cutanées graves et la procédure à suivre, voir rubrique 4. Chez les personnes d'origine chinoise ou asiatique, ce risque peut être associé à un variant génétique. Si vous êtes dorigine chinoise ou asiatique et que des tests ont montré que vous êtes porteur du variant génétique HLA-B*1502, ou si vous êtes d'origine taïwanaise, japonaise, malaisienne ou thaïlandaise et que des tests ont montré que vous êtes porteur du variant génétique CYP2C9*3, parlez-en avec votre médecin avant de prendre ce médicament.
Réactions allergiques
Des cas de gonflement du visage, de la bouche (lèvres, gencives, langue) et de la gorge pouvant entraîner des difficultés respiratoires mettant en jeu le pronostic vital ont été signalés chez des personnes traitées par phénytoïne et fosphénytoïne. Si, à tout moment, vous présentez ces signes ou symptômes, contactez immédiatement votre médecin.
Risque durant la grossesse
Il existe un risque d'effets néfastes pour l'enfant à naître si FOSPHENYTOINE ARROW est utilisé pendant la grossesse. Les femmes en âge de procréer doivent utiliser une méthode de contraception efficace pendant la prise de FOSPHENYTOINE ARROW (voir « Grossesse et allaitement »).
EnfantsSans objet.
Autres médicaments et FOSPHENYTOINE ARROW 75 mg/mL, solution à diluer pour solution injectable/pour perfusionInformez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Certains médicaments peuvent affecter la façon dont FOSPHENYTOINE ARROW agit, ou FOSPHENYTOINE ARROW lui-même peut réduire l'efficacité d'autres médicaments pris en même temps. Il est important que votre médecin connaisse tous les autres médicaments que vous prenez. Cela inclut les médicaments disponibles avec ou sans ordonnance (y compris l'acide folique ou la vitamine D) et les médicaments à base de plantes.
La liste ci-dessous ne comprend que les affections à traiter et non les substances actives réelles. Votre médecin ou pharmacien sera en mesure de vous donner plus d'informations.
Veuillez informer votre médecin ou pharmacien si vous prenez ou utilisez tout médicament pour traiter, prévenir :
·les problèmes de cur et de circulation sanguine ;
·l'épilepsie ;
·les infections fongiques ;
·l'infection par le virus de l'immunodéficience humaine (VIH) ;
·la tuberculose et les autres infections ;
·les ulcères d'estomac ou brulures d'estomac ;
·l'asthme et la bronchite (théophylline) ;
·la douleur et l'inflammation ;
·l'insomnie, la dépression et les troubles psychiatriques ;
·le diabète ;
·le cancer ;
·le rejet en cas de greffe d'organes et de tissus ou si vous prenez des corticostéroïdes ;
·les traitements hormonaux substitutifs (strogènes), les contraceptifs oraux (la pilule contraceptive) (voir rubrique « Grossesse et Allaitement ») ;
·les relaxants musculaires utilisés pour la chirurgie et certains médicaments anesthésiques.
Votre médecin devra peut-être mesurer la quantité de phénytoïne dans votre sang pour déterminer si vos autres médicaments affectent votre traitement.
Toute préparation à base de plantes de millepertuis (Hypericum perforatum) ne doit pas être prise en même temps que ce médicament. Si vous avez déjà pris du millepertuis, consultez votre médecin avant d'arrêter la prise de millepertuis.
Ce médicament peut également interférer avec certains tests de laboratoire.
FOSPHENYTOINE ARROW 75 mg/mL, solution à diluer pour solution injectable/pour perfusion avec de l'alcoolUne consommation aiguë ou régulière d'alcool peut altérer les concentrations sanguines de ce médicament.
Grossesse et allaitement GrossesseSi vous êtes enceinte, consultez rapidement votre médecin. Vous ne devez pas arrêter de prendre votre médicament tant que vous n'en avez pas discuté avec votre médecin. Arrêter de prendre votre médicament sans consulter votre médecin pourrait provoquer des crises convulsives qui pourraient être dangereuses pour vous et l'enfant à naître. Votre médecin pourrait décider de modifier votre traitement. Une surveillance plus étroite de l'enfant à naître pourrait également être envisagée.
FOSPHENYTOINE ARROW peut provoquer des malformations congénitales. Si vous prenez ce médicament pendant la grossesse, le risque que votre bébé présente une malformation congénitale sera plus élevé. Les malformations congénitales ayant été rapportées comprennent des anomalies au niveau du visage, du crâne, des ongles, des doigts et du cur.
Si vous êtes en âge de procréer et planifiez une grossesse, consultez votre médecin pour effectuer une visite pré conceptionnelle. Vous devriez échanger avec votre médecin au sujet des options thérapeutiques.
Si vous prenez ce médicament pendant la grossesse, votre bébé peut également présenter un risque de saignement à la naissance. Pour l'éviter, votre médecin pourra vous administrer un médicament à vous et à votre bébé. De plus, votre enfant doit être étroitement surveillé.
Contraception chez les femmesSi vous êtes en âge de procréer, vous devriez discuter avec votre médecin de vos options de traitement et des méthodes de contraception efficaces. Ce médicament peut conduire à un échec des contraceptifs hormonaux, par conséquent vous devriez être informées de l'utilisation d'autres méthodes contraceptives efficaces.
AllaitementLa fosphénytoïne passe dans le lait maternel. Vous ne devez pas prendre ce médicament si vous allaitez.
Conduite de véhicules et utilisation de machinesCe médicament peut provoquer des étourdissements ou une somnolence. Si vous présentez ces symptômes, ne conduisez pas et n'utilisez aucun outil ou machine.
FOSPHENYTOINE ARROW 75 mg/mL, solution à diluer pour solution injectable/pour perfusion contient du sodiumLors du calcul de la quantité totale de sodium, toute dilution de fosphénytoïne sodique injectée avec une solution de chlorure de sodium doit être prise en compte.
Chaque flacon de 10 mL contient 85 mg de sodium (composant principal du sel de cuisine/table). Cela équivaut à 4,25 % de l'apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
Vous serez à l'hôpital lorsque vous recevrez ce médicament.
Il sera injecté dans l'une de vos grosses veines (perfusion intraveineuse) ou dans votre muscle (par voie intramusculaire). Lorsqu'il est administré par voie intraveineuse, ce médicament doit être dilué.
Votre activité cardiaque sera surveillée en continu par électrocardiogramme, ainsi que votre tension artérielle et votre fonction respiratoire pendant toute la durée de la perfusion et environ 30 minutes après la fin de la perfusion.
La posologie et la concentration de la solution de FOSPHENYTOINE ARROW qui vous sera administrée seront déterminées par votre médecin, en fonction de votre état et de votre poids. La posologie sera exprimée en équivalent de phénytoïne sodique (EP). Cela permet à votre médecin de calculer plus facilement la posologie de fosphénytoïne en phénytoïne ou vice versa. La concentration sera exprimée en milligrammes par dose si administrée en injection ou en milligramme par millilitre (mg/mL) si administrée par perfusion.
Utilisation chez les adultes· Crise d'épilepsie sévère ou état de mal épileptique
FOSPHENYTOINE ARROW est généralement administré après un traitement par injection de diazépam ou de lorazépam.
La première dose de FOSPHENYTOINE ARROW est la dose de charge et est injectée dans votre veine. Après la dose de charge, vous pouvez recevoir des doses plus faibles de ce médicament, par voie intraveineuse ou intramusculaire. Ces doses sont appelées doses d'entretien.
Si ce médicament n'arrête pas vos crises, d'autres traitements seront essayés.
· Chirurgie cérébrale ou traumatisme crânien
La première dose est la dose de charge et est injectée dans votre veine ou votre muscle. Après la dose de charge, vous pouvez recevoir des doses plus faibles de FOSPHENYTOINE ARROW, par voie intraveineuse ou intramusculaire. Ces doses sont appelées doses d'entretien.
· Doses d'entretien
Votre médecin peut prélever des échantillons de votre sang pour déterminer la dose d'entretien qui vous convient.
Si votre médecin décide que vous devez poursuivre le traitement, un traitement par voie orale vous sera prescrit. Cela se fera avec de la phénytoïne car ce médicament (fosphénytoïne) ne peut pas être pris par voie orale.
· Remplacement temporaire de la phénytoïne orale
Si vous prenez FOSPHENYTOINE ARROW parce que vous ne pouvez pas prendre de phénytoïne par voie orale, vous n'avez pas besoin de dose de charge et la dose qui vous sera administrée sera la même que votre dose de phénytoïne. Etant donné que la dose de fosphénytoïne est donnée en EP (équivalents de phénytoïne sodique), le nombre de mg d'EP de FOSPHENYTOINE ARROW que vous recevez doit être identique au nombre de mg de phénytoïne sodique que vous prenez par voie orale.
Utilisation chez les enfants âgés de 5 ans et plusLes doses de FOSPHENYTOINE ARROW par kilogramme de poids corporel sont les mêmes pour les enfants (âgés de 5 ans et plus) que pour les adultes.
Ce médicament est administré aux enfants âgés de 5 ans et plus par un goutte-à-goutte (perfusion) dans une veine (voie intraveineuse) uniquement.
Patients âgés de plus de 65 ans, patients très malades et patients présentant une maladie du rein ou du foie
La dose de ce médicament peut être réduite ou l'injection intraveineuse peut être faite à un rythme plus lent.
Si vous avez utilisé plus de FOSPHENYTOINE ARROW 75 mg/mL, solution à diluer pour solution injectable/pour perfusion que vous n'auriez dûFOSPHENYTOINE ARROW est dangereux en cas de surdosage. Cependant, ce médicament vous est administré à l'hôpital et la dose est calculée pour vous individuellement. Le médecin vous surveillera pendant le traitement et un équipement de réanimation cardiaque sera disponible.
Si vous pensez avoir pris trop de ce médicament, contactez immédiatement votre médecin.
Si vous oubliez d'utiliser FOSPHENYTOINE ARROW 75 mg/mL, solution à diluer pour solution injectable/pour perfusion Si vous arrêtez d'utiliser FOSPHENYTOINE ARROW 75 mg/mL, solution à diluer pour solution injectable/pour perfusionSans objet.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Si vous ressentez l'un des symptômes suivants après avoir pris ce médicament, informez-en immédiatement votre médecin. Bien qu'ils puissent être peu fréquents, ces symptômes peuvent être graves.
Peu fréquent : peut affecter jusqu'à 1 personne sur 100
·si vous développez une éruption cutanée grave provoquant des cloques (pouvant également toucher la bouche et la langue). Ces réactions cutanées sont souvent accompagnées de fièvre ou de symptômes pseudo-grippaux. Ceux-ci peuvent être des signes d'une affection connue sous le nom de syndrome de Stevens-Johnson ou d'une nécrolyse épidermique toxique (NET). Votre médecin arrêtera votre traitement dans ce cas.
Fréquence indéterminée : ne peut pas être estimée sur la base des données disponibles·si vous remarquez des ecchymoses, de la fièvre, que vous êtes pâle ou que vous présentez un mal de gorge sévère. Ceux-ci peuvent être les premiers signes d'une anomalie du sang, telles que la diminution du nombre de globules rouges, de globules blancs ou de plaquettes. Votre médecin peut prélever des échantillons de sang régulièrement pour surveiller votre numération globulaire ;
·éruption cutanée et fièvre avec gonflement des glandes, accompagnée d'une coloration jaune de la peau et des yeux, en particulier au cours des deux premiers mois de traitement, car ils peuvent être le signe d'une réaction d'hypersensibilité. Si ceux-ci sont graves et que vous ressentez également une douleur et une inflammation des articulations, cela pourrait être lié à une affection appelée lupus érythémateux systémique ;
·si vous ressentez une décoloration de la peau, un gonflement et une douleur au point d'injection qui commence à s'étendre le long de votre bras jusqu'à vos mains et vos doigts. Cela peut signifier que vous avez une maladie connue sous le nom de « syndrome de la main pourpre ». Dans la plupart des cas, cela s'améliorera tout seul, mais dans certains cas, cela peut s'aggraver et nécessiter un traitement médical urgent ;
·zones de peau avec rougeurs et pustules stériles apparentes (petites vésicules remplies de liquide blanc/jaune). Il semble y en avoir davantage dans les plis cutanés. Un gonflement du visage peut également survenir (pustulose exanthématique aiguë généralisée [PEAG]) ;
·éruption cutanée, fièvre, gonflement des glandes, augmentation du nombre de globules blancs (éosinophilie) et inflammation des organes internes (foie, poumons, cur, reins et gros intestin), pouvant être le signe d'une réaction d'hypersensibilité (réaction médicamenteuse avec augmentation des polynucléaires éosinophiles et symptômes systémiques [DRESS]) ;
·si vous présentez un état de confusion ou une maladie mentale grave, cela peut indiquer que votre sang contient de grandes quantités de phénytoïne. Dans de rares cas, lorsque la phénytoïne dans le sang reste élevée, des lésions cérébrales irréversibles se sont produites. Votre médecin peut analyser votre sang pour déterminer la quantité de phénytoïne dans votre sang et adapter la posologie ;
·respiration sifflante soudaine, difficulté à respirer, gonflement des paupières, du visage ou des lèvres, éruption cutanée ou démangeaisons (touchant tout le corps), pouvant être le signe d'une réaction d'hypersensibilité.
Les autres effets secondaires pouvant survenir sont :
Très fréquent : peut affecter plus de 1 personne sur 10Fréquent : pouvant affecter jusqu'à 1 personne sur 10
·saute d'humeur, picotements, instabilité, somnolence, maux de tête, tremblements, mouvements anormaux ou mal coordonnés, troubles de l'élocution, vision floue ;
·bourdonnements dans les oreilles, vertiges ;
·sensation de malaise, de bouche sèche, de devenir malade ;
·douleur ou réaction au site d'injection ;
·perte d'énergie ou de force, frissons.
Peu fréquent : peut affecter jusqu'à 1 personne sur 100·nervosité, confusion, pensées anormales/irrationnelles ;
·engourdissement ;
·vision double, perte de l'audition ;
·perte de sensation dans la langue ;
·éruption cutanée comprenant des réactions bénignes ressemblant à la rougeole ;
·faiblesse musculaire, contractions musculaires, muscles douloureux.
Fréquence indéterminée : ne peut pas être estimée sur la base des données disponibles·urticaire ;
·gonflement des ganglions lymphatiques ;
·inflammation des parois des artères, problèmes de défense de l'organisme contre les infections ;
·augmentation du taux de sucre dans le sang ou diminution du calcium, de l'acide folique et de la vitamine D. Si vous ne consommez pas suffisamment de vitamine D dans votre alimentation ou en raison de l'exposition au soleil, vous pouvez souffrir de douleurs ou de fractures au niveau des os ;
·des cas de troubles osseux, notamment d'ostéopénie et d'ostéoporose (amincissement des os) et de fractures ont été rapportés. Consultez votre médecin ou votre pharmacien si vous prenez des antiépileptiques depuis longtemps, si vous avez des antécédents d'ostéoporose ou si vous prenez des stéroïdes ;
·changement d'appétit, difficulté à contrôler les mouvements, insomnie, convulsions ;
·inflammation de la muqueuse du poumon, problèmes de respiration ;
·gencives dilatées, constipation ;
·inflammation du foie, dommages au foie (apparaissant comme un jaunissement de la peau et du blanc de l'il) ;
·augmentation anormale de la pilosité du corps ou du visage, modification des traits du visage, hypertrophie des lèvres, modifications des mains rendant difficile le redressement des doigts ;
·inflammation des reins ;
·des démangeaisons, des brûlures, une sensation de chaleur ou des picotements temporaires peuvent parfois survenir pendant ou peu de temps après l'injection de fosphénytoïne dans votre veine. Votre médecin peut réduire le débit d'injection de fosphénytoïne ou arrêter temporairement l'injection de fosphénytoïne si vous ressentez ces sensations.
Déclaration des effets secondairesSi vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d'informations sur la sécurité du médicament.
Tenir ce médicament hors de la vue et de la portée des enfants.
N'utilisez pas ce médicament après la date de péremption indiquée sur l'emballage et le flacon après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver au réfrigérateur (2°C - 8°C).
La stabilité physico-chimique du produit dilué a été démontrée pendant 4 heures à 25°C. D'un point de vue microbiologique, à moins que la méthode de dilution n'exclue le risque de contamination microbienne, le produit doit être utilisé immédiatement. En cas d'utilisation non immédiate, les durées et les conditions de conservation relèvent de la responsabilité de l'utilisateur.
A usage unique. Après ouverture, le produit non utilisé devra être jeté.
Les flacons contenant des particules ne doivent pas être utilisés.
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d'éliminer les médicaments que vous n'utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L'EMBALLAGE ET AUTRES INFORMATIONS
1 mL de FOSPHENYTOINE ARROW contient 75 mg de fosphénytoïne sodique (équivalent à 50 mg de phénytoïne sodique et correspondant à 50 mg d'EP).
Chaque flacon de 10 mL contient 750 mg de fosphénytoïne sodique (équivalent à 500 mg de phénytoïne sodique et correspondant à 500 mg d'EP).
·Les autres composants sont : trométamol, acide chlorhydrique (pour l'ajustement du pH), hydroxyde de sodium (pour l'ajustement du pH) et eau pour préparations injectables.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l'autorisation de mise sur le marché
EUGIA PHARMA (MALTA) LTDVAULT 14, LEVEL 2
VALLETTA WATERFRONT
FLORIANA, FRN 1914
MALTE
Exploitant de l'autorisation de mise sur le marché
ARROW GENERIQUES26 AVENUE TONY GARNIER
69007 LYON
RECIPHARM MONTS - MONTS
18 RUE DE MONTBAZON
37260 MONTS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
à compléter ultérieurement par le titulaire]
{mois AAAA}.Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l'ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
FOSPHENYTOINE ARROW (fosphénytoïne)Guide posologique destiné au traitement d'urgence de l'état de mal épileptique Réservé à l'adulte uniquementDes décès se sont produits en raison d'erreurs médicamenteuses avec la fosphénytoïne.
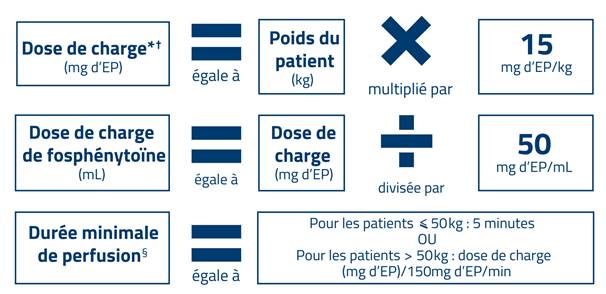
Mode d'emploi : Ce guide posologique a été conçu pour vous aider à administrer une dose de charge de fosphénytoïne. Utilisez les équations et/ou consultez le tableau ci-dessous afin de déterminer la dose de charge ainsi que le temps de perfusion appropriés en fonction du poids du patient.
POSOLOGIE ADULTE UNIQUEMENTConsultez le Résumé des Caractéristiques du Produit (RCP) pour des informations complètes sur la prescription.
Prenez soin de vous assurer que la dose correcte de fosphénytoïne est administrée. NOTEZ QUE :1. Chaque flacon de 10 mL de fosphénytoïne contient 500 mg d'EP.
EP = équivalents de phénytoïne sodique.
2. La fosphénytoïne doit toujours être prescrite et administrée en mg d'EP.
Administration de la dose de charge1. Administrez 15 milligrammes d'équivalents de phénytoïne sodique (EP) par kilogramme (15 mg d'EP/kg) en dose unique en perfusion intraveineuse (IV).
·Pour la perfusion IV, diluez la dose dans une solution de glucose à 5 % ou dans une solution de chlorure de sodium à 0,9 %.
·La vitesse de perfusion ne doit pas dépasser 150 mg d'EP/min pour les adultes.
2. Il est impératif de surveiller l'ECG, la tension artérielle et la fonction respiratoire pendant et après la perfusion de fosphénytoïne (en particulier au cours des 30 premières minutes suivant l'administration). Un équipement de réanimation cardiaque doit être disponible.
3. Chez les patients âgés et les patients présentant une maladie rénale et/ou hépatique, envisager de diminuer la dose de charge et/ou le débit de perfusion (réduction de 10 à 25 %). Une surveillance clinique étroite est nécessaire.
Voir le tableau ci-dessous pour les durées minimales de perfusion.
ATTENTION : ce guide posologique est uniquement destiné au traitement d'urgence de l'état de mal épileptique. Consultez le RCP pour les informations relatives à la posologie d'entretien.Dose de charge, volume de diluant et durée minimale de perfusion en fonction du poids du patient (en kg).
|
|
* La dose de charge peut nécessiter l'ouverture de plus d'un flacon. Voir le conditionnement pour plus d'informations.
Avant l'administration IV, ajoutez un volume de diluant égal à celui de la dose de charge de fosphénytoïne en mL.
§ Le respect de la durée minimale de perfusion est crucial en raison du risque d'événements cardiovasculaires.
Veuillez utiliser le tableau ci-dessous pour confirmer tous vos calculs.
| Adulte | |||||
|
Poids du patient (kg) |
Dose de charge de fosphénytoïne |
||||
|
En milligramme d'équivalents de phénytoïne sodique (mg d'EP) |
En millilitres de fosphénytoïne (mL) |
Nombre de flacons nécessaires |
Volume de diluant à ajouter (mL) |
Durée minimale de perfusion (min) |
|
|
120a |
1800 |
36 |
3 complets + 1 partiel |
36 |
12 |
|
119 |
1785 |
35,7 |
3 complets + 1 partiel |
35,7 |
12 |
|
118 |
1770 |
35,4 |
3 complets + 1 partiel |
35,4 |
12 |
|
117 |
1755 |
35,1 |
3 complets + 1 partiel |
35,1 |
12 |
|
116 |
1740 |
34,8 |
3 complets + 1 partiel |
34,8 |
12 |
|
115 |
1725 |
34,5 |
3 complets + 1 partiel |
34,5 |
12 |
|
114 |
1710 |
34,2 |
3 complets + 1 partiel |
34,2 |
12 |
|
113 |
1695 |
33,9 |
3 complets + 1 partiel |
33,9 |
12 |
|
112 |
1680 |
33,6 |
3 complets + 1 partiel |
33,6 |
12 |
|
111 |
1665 |
33,3 |
3 complets + 1 partiel |
33,3 |
12 |
|
110 |
1650 |
33 |
3 complets + 1 partiel |
33 |
11 |
|
109 |
1635 |
32,7 |
3 complets + 1 partiel |
32,7 |
11 |
|
108 |
1620 |
32,4 |
3 complets + 1 partiel |
32,4 |
11 |
|
107 |
1605 |
32,1 |
3 complets + 1 partiel |
32,1 |
11 |
|
106 |
1590 |
31,8 |
3 complets + 1 partiel |
31,8 |
11 |
|
105 |
1575 |
31,5 |
3 complets + 1 partiel |
31,5 |
11 |
|
104 |
1560 |
31,2 |
3 complets + 1 partiel |
31,2 |
11 |
|
103 |
1545 |
30,9 |
3 complets + 1 partiel |
30,9 |
11 |
|
102 |
1530 |
30,6 |
3 complets + 1 partiel |
30,6 |
11 |
|
101 |
1515 |
30,3 |
3 complets + 1 partiel |
30,3 |
11 |
|
100 |
1500 |
30 |
3 complets |
30 |
10 |
|
99 |
1485 |
29,7 |
2 complets + 1 partiel |
29,7 |
10 |
|
98 |
1470 |
29,4 |
2 complets + 1 partiel |
29,4 |
10 |
|
97 |
1455 |
29,1 |
2 complets + 1 partiel |
29,1 |
10 |
|
96 |
1440 |
28,8 |
2 complets + 1 partiel |
28,8 |
10 |
|
95 |
1425 |
28,5 |
2 complets + 1 partiel |
28,5 |
10 |
|
94 |
1410 |
28,2 |
2 complets + 1 partiel |
28,2 |
10 |
|
93 |
1395 |
27,9 |
2 complets + 1 partiel |
27,9 |
10 |
|
92 |
1380 |
27,6 |
2 complets + 1 partiel |
27,6 |
10 |
|
91 |
1365 |
27,3 |
2 complets + 1 partiel |
27,3 |
10 |
|
90 |
1350 |
27 |
2 complets + 1 partiel |
27 |
9 |
|
89 |
1335 |
26,7 |
2 complets + 1 partiel |
26,7 |
9 |
|
88 |
1320 |
26,4 |
2 complets + 1 partiel |
26,4 |
9 |
|
87 |
1305 |
26,1 |
2 complets + 1 partiel |
26,1 |
9 |
|
86 |
1290 |
25,8 |
2 complets + 1 partiel |
25,8 |
9 |
|
85 |
1275 |
25,5 |
2 complets + 1 partiel |
25,5 |
9 |
|
84 |
1260 |
25,2 |
2 complets + 1 partiel |
25,2 |
9 |
|
83 |
1245 |
24,9 |
2 complets + 1 partiel |
24,9 |
9 |
|
82 |
1230 |
24,6 |
2 complets + 1 partiel |
24,6 |
9 |
|
81 |
1215 |
24,3 |
2 complets + 1 partiel |
24,3 |
9 |
|
80 |
1200 |
24 |
2 complets + 1 partiel |
24 |
8 |
|
79 |
1185 |
23,7 |
2 complets + 1 partiel |
23,7 |
8 |
|
78 |
1170 |
23,4 |
2 complets + 1 partiel |
23,4 |
8 |
|
77 |
1155 |
23,1 |
2 complets + 1 partiel |
23,1 |
8 |
|
76 |
1140 |
22,8 |
2 complets + 1 partiel |
22,8 |
8 |
|
75 |
1125 |
22,5 |
2 complets + 1 partiel |
22,5 |
8 |
|
74 |
1110 |
22,2 |
2 complets + 1 partiel |
22,2 |
8 |
|
73 |
1095 |
21,9 |
2 complets + 1 partiel |
21,9 |
8 |
|
72 |
1080 |
21,6 |
2 complets + 1 partiel |
21,6 |
8 |
|
71 |
1065 |
21,3 |
2 complets + 1 partiel |
21,3 |
8 |
|
70 |
1050 |
21 |
2 complets + 1 partiel |
21 |
7 |
|
69 |
1035 |
20,7 |
2 complets + 1 partiel |
20,7 |
7 |
|
68 |
1020 |
20,4 |
2 complets + 1 partiel |
20,4 |
7 |
|
67 |
1005 |
20,1 |
2 complets + 1 partiel |
20,1 |
7 |
|
66 |
990 |
19,8 |
1 complet + 1 partiel |
19,8 |
7 |
|
65 |
975 |
19,5 |
1 complet + 1 partiel |
19,5 |
7 |
|
64 |
960 |
19,2 |
1 complet + 1 partiel |
19,2 |
7 |
|
63 |
945 |
18,9 |
1 complet + 1 partiel |
18,9 |
7 |
|
62 |
930 |
18,6 |
1 complet + 1 partiel |
18,6 |
7 |
|
61 |
915 |
18,3 |
1 complet + 1 partiel |
18,3 |
7 |
|
60 |
900 |
18 |
1 complet + 1 partiel |
18 |
6 |
|
59 |
885 |
17,7 |
1 complet + 1 partiel |
17,7 |
6 |
|
58 |
870 |
17,4 |
1 complet + 1 partiel |
17,4 |
6 |
|
57 |
855 |
17,1 |
1 complet + 1 partiel |
17,1 |
6 |
|
56 |
840 |
16,8 |
1 complet + 1 partiel |
16,8 |
6 |
|
55 |
825 |
16,5 |
1 complet + 1 partiel |
16,5 |
6 |
|
54 |
810 |
16,2 |
1 complet + 1 partiel |
16,2 |
6 |
|
53 |
795 |
15,9 |
1 complet + 1 partiel |
15,9 |
6 |
|
52 |
780 |
15,6 |
1 complet + 1 partiel |
15,6 |
6 |
|
51 |
765 |
15,3 |
1 complet + 1 partiel |
15,3 |
6 |
|
50 |
750 |
15 |
1 complet + 1 partiel |
15 |
5 |
|
49 |
735 |
14,7 |
1 complet + 1 partiel |
14,7 |
5 |
|
48 |
720 |
14,4 |
1 complet + 1 partiel |
14,4 |
5 |
|
47 |
705 |
14.1 |
1 complet + 1 partiel |
14,1 |
5 |
|
46 |
690 |
13,8 |
1 complet + 1 partiel |
13,8 |
5 |
|
45 |
675 |
13,5 |
1 complet + 1 partiel |
13,5 |
5 |
|
44a |
660 |
13,2 |
1 complet + 1 partiel |
13,2 |
5 |
a Voir rubrique « Administration de la dose de charge » ci-dessus pour les patients de poids < 44 kg ou > 120 kg.
Veuillez consulter le Résumé des Caractéristiques du Produit (RCP) pour toute information complémentaire.
FOSPHENYTOINE ARROW (fosphénytoïne)Guide posologique destiné au traitement d'urgence de l'état de mal épileptiqueRéservé aux enfants âgés de 5 ans et plus uniquementDes décès se sont produits en raison d'erreurs médicamenteuses avec la fosphénytoïne.
NE PAS administrer aux enfants âgés de moins de 5 ans.Mode d'emploi : Ce guide posologique a été conçu pour vous aider à administrer une dose de charge de fosphénytoïne. Utilisez les équations et/ou consultez le tableau ci-dessous afin de déterminer la dose de charge ainsi que le temps de perfusion appropriés en fonction du poids du patient.
RÉSERVÉ AUX ENFANTS ÂGÉS DE 5 ANS ET PLUS UNIQUEMENT
Consultez le Résumé des Caractéristiques du Produit (RCP) pour des informations complètes sur la prescription.
Prenez soin de vous assurer que la dose correcte de fosphénytoïne est administrée.NOTEZ QUE :1. Chaque flacon de 10 mL de fosphénytoïne contient 500 mg d'EP. EP = équivalents de phénytoïne sodique.
2. La fosphénytoïne doit toujours être prescrite et administrée en mg d'EP.
Administration de la dose de charge1. La dose de charge de fosphénytoïne est de 15 milligrammes d'équivalents de phénytoïne sodique (EP) par kilogramme (15 mg d'EP/kg) administrés en dose unique en perfusion intraveineuse (IV). L'administration intramusculaire n'est pas recommandée.
·Le débit de perfusion IV recommandé est de 2 à 3 mg d'EP/kg/min. Ne pas dépasser 3 mg d'EP/kg/min ou 150 mg d'EP/min, prenez le débit le plus lent des deux.
·Pour la perfusion IV, diluez la dose dans une solution de glucose à 5 % ou dans une solution de chlorure de sodium à 0,9 %.
2. Il est impératif de surveiller l'ECG, la tension artérielle et la fonction respiratoire pendant et après la perfusion de fosphénytoïne (en particulier au cours des 30 premières minutes suivant l'administration). Un équipement de réanimation cardiaque doit être disponible.
3. Chez les patients présentant une maladie rénale et/ou hépatique, envisager de diminuer la dose de charge et/ou le débit de perfusion (réduction de 10 à 25 %). Une surveillance clinique étroite est nécessaire.
Voir le tableau ci-dessous pour les durées minimales de perfusion.
ATTENTION : ce guide posologique est uniquement destiné au traitement d'urgence de l'état de mal épileptique. Consultez le RCP pour les informations relatives à la posologie d'entretien.Dose de charge, volume de diluant et durée minimale de perfusion en fonction du poids du patient en kg.
* Peut nécessiter l'ouverture de plus d'un flacon. Voir le conditionnement pour plus d'informations.
Avant l'administration IV, ajoutez un volume de diluant égal à celui de la dose de charge de fosphénytoïne en mL.
§ Le respect de la durée minimale de perfusion est crucial en raison du risque d'événements cardiovasculaires.
Veuillez utiliser le tableau ci-dessous pour confirmer tous vos calculs.
| ENFANTS ÂGÉS DE 5 ANS ET PLUS | |||||
|
Poids du patient (kg) |
Dose de charge de fosphénytoïne |
||||
|
En milligramme d'équivalents de phénytoïne sodique (mg d'EP) |
En millilitres de fosphénytoïne (mL) |
Nombre de flacons nécessaires |
Volume de diluant à ajouter (mL) |
Durée minimale de perfusion (min) |
|
|
44a |
660 |
13,2 |
1 complet + 1 partiel |
13,2 |
5 |
|
43 |
645 |
12,9 |
1 complet + 1 partiel |
12,9 |
5 |
|
42 |
630 |
12,6 |
1 complet + 1 partiel |
12,6 |
5 |
|
41 |
615 |
12,3 |
1 complet + 1 partiel |
12,3 |
5 |
|
40 |
600 |
12 |
1 complet + 1 partiel |
12 |
5 |
|
39 |
585 |
11,7 |
1 complet + 1 partiel |
11,7 |
5 |
|
38 |
570 |
11,4 |
1 complet + 1 partiel |
11,4 |
5 |
|
37 |
555 |
11,1 |
1 complet + 1 partiel |
11,1 |
5 |
|
36 |
540 |
10,8 |
1 complet + 1 partiel |
10,8 |
5 |
|
35 |
525 |
10,5 |
1 complet + 1 partiel |
10,5 |
5 |
|
34 |
510 |
10,2 |
1 complet + 1 partiel |
10,2 |
5 |
|
33 |
495 |
9,9 |
1 partiel |
9,9 |
5 |
|
32 |
480 |
9,6 |
1 partiel |
9,6 |
5 |
|
31 |
465 |
9,3 |
1 partiel |
9,3 |
5 |
|
30 |
450 |
9 |
1 partiel |
9 |
5 |
|
29 |
435 |
8,7 |
1 partiel |
8,7 |
5 |
|
28 |
420 |
8,4 |
1 partiel |
8,4 |
5 |
|
27 |
405 |
8,1 |
1 partiel |
8,1 |
5 |
|
26 |
390 |
7,8 |
1 partiel |
7,8 |
5 |
|
25 |
375 |
7,5 |
1 partiel |
7,5 |
5 |
|
24 |
360 |
7,2 |
1 partiel |
7,2 |
5 |
|
23 |
345 |
6,9 |
1 partiel |
6,9 |
5 |
|
22 |
330 |
6,6 |
1 partiel |
6,6 |
5 |
|
21 |
315 |
6,3 |
1 partiel |
6,3 |
5 |
|
20 |
300 |
6 |
1 partiel |
6 |
5 |
|
19 |
285 |
5,7 |
1 partiel |
5,7 |
5 |
|
18 |
270 |
5,4 |
1 partiel |
5,4 |
5 |
|
17a |
255 |
5,1 |
1 partiel |
5,1 |
5 |
a Voir rubrique « Administration de la dose de charge » ci-dessus pour les patients de poids < 17 kg ou > 44 kg.
Veuillez consulter le Résumé des Caractéristiques du Produit (RCP) pour toute information complémentaire.